Definición de mercado
El mercado abarca el desarrollo, la fabricación y la comercialización de la terapéutica biológica diseñada para la entrega pulmonar. El mercado se ve impulsado por la creciente demanda de suministro de fármacos no invasivos, el progreso en las tecnologías de inhalación y la creciente prevalencia de afecciones respiratorias y sistémicas.
Las partes interesadas clave incluyen compañías biofarmacéuticas, proveedores de atención médica y organismos regulatorios. El informe destaca los impulsores principales del mercado, junto con tendencias significativas, marcos regulatorios y el panorama competitivo, que dan forma a la expansión del mercado en los próximos años.
Mercado de productos biológicos inhalablesDescripción general
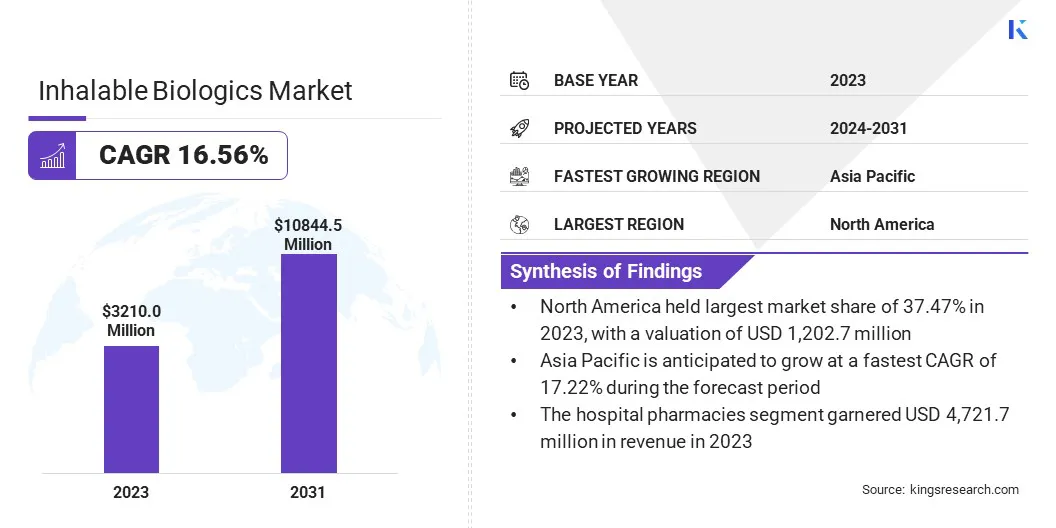
El tamaño mundial del mercado de biológicos inhalables se valoró en USD 3,210.0 millones en 2023 y se prevé que crecerá de USD 3,710.4 millones en 2024 a USD 10,844.5 millones para 2031, exhibiendo una Cagr en 16.56% durante el período de pronóstico.
Este mercado está registrando un crecimiento significativo, impulsado por los avances en las tecnologías de suministro de fármacos, el aumento de la prevalencia de enfermedades respiratorias y la creciente demanda de opciones de tratamiento no invasivas. El mercado se beneficia de las innovaciones continuas en las técnicas de formulación, que permite que los productos biológicos como los anticuerpos monoclonales, los péptidos y las proteínas se entreguen de manera efectiva mediante inhalación.
La adopción en expansión de productos biológicos para afecciones más allá de los trastornos respiratorios, incluidas las enfermedades sistémicas, acelera aún más la expansión del mercado. Las asociaciones estratégicas entre compañías farmacéuticas, empresas de biotecnología y fabricantes de dispositivos están fomentando la innovación y el éxito comercial.
Major companies operating in the inhalable biologics industry are AstraZeneca, MannKind Corporation, Synairgen plc., Pulmocide, Aerogen Ltd, Liquidia Corporation, Nephron Pharmaceuticals Corporation, InCarda Therapeutics, Inc., Agomab Therapeutics, Acu-Flow Limited, ReCode Therapeutics, AATec Medical GmbH, Avalyn Pharma Inc., VERO Biotech, y Spexis Ltd.
Además, las crecientes inversiones en investigación y desarrollo, junto con marcos regulatorios favorables, están respaldando la rápida introducción de novedosos inhalablesbiológicos.
La creciente preferencia por las terapias centradas en el paciente, impulsadas por una mayor conveniencia, eficacia y suministro de fármacos dirigidos, está impulsando aún más el crecimiento del mercado. El mercado continúa evolucionando como un segmento clave en la terapéutica moderna a medida que los proveedores de atención médica y los pacientes buscan soluciones de tratamiento efectivas y no invasivas.
- En enero de 2025, Iconovo AB y Lonza anunciaron su colaboración para desarrollar formulaciones secadas por spray para un candidato biológico de drogas entregados intranasalmente dirigidos a la obesidad. La asociación se centra en utilizar el dispositivo nasal Icoone patentado para Iconovo para la administración no invasiva de medicamentos. El sitio de Bend de Lonza, especializado en mejora de biodisponibilidad y suministro inhalado, optimizará el tamaño de las partículas, la estabilidad y la actividad biológica para garantizar la compatibilidad con el dispositivo nasal.
Destacados clave:
- El tamaño de la industria biológica inhalable se valoró en USD 3,210.0 millones en 2023.
- Se proyecta que el mercado crecerá a una tasa compuesta anual del 16.56% de 2024 a 2031.
- América del Norte tenía una cuota de mercado del 37.47% en 2023, con una valoración de USD 1.202.7 millones.
- El segmento de proteínas y péptidos obtuvo USD 939.8 millones en ingresos en 2023.
- Se espera que el segmento de diabetes alcance los USD 3,796.7 millones para 2031.
- Se espera que el segmento de inhaladores de polvo seco alcance USD 1.260.7 millones para 2031.
- Se espera que el segmento de farmacias del hospital alcance USD 1.389.7 millones para 2031.
- Se anticipa que el mercado en Asia Pacífico crece a una tasa compuesta anual del 17.22% durante el período de pronóstico.
Conductor de mercado
Creciente demanda de suministro de medicamentos no invasivos
El mercado está siendo impulsado por la creciente demanda de suministro de fármacos no invasivos y el creciente interés en la inmunidad de la mucosa y las vacunas inhaladas. Los productos biológicos inyectables tradicionales, aunque efectivos, a menudo plantean desafíos como dolor, fobia con aguja, riesgo de infección y la necesidad de administración profesional de la salud.
Los productos biológicos inhalables proporcionan una alternativa sin aguja amigable para el paciente que mejora el cumplimiento, la conveniencia y la facilidad de autoadministración. Este cambio hacia la administración no invasiva de fármacos es particularmente importante para afecciones crónicas y enfermedades infecciosas, donde se puede requerir una dosis frecuente.
Además, la inmunidad de la mucosa y las vacunas inhaladas han ganado la tracción como un enfoque prometedor para la prevención y el tratamiento de la enfermedad. Las vacunas inhaladas activan respuestas inmunes directamente en las superficies mucosas, los puntos de entrada principales para muchos patógenos, a diferencia de las vacunas tradicionales que estimulan la inmunidad sistémica.
Esta respuesta inmune dirigida no solo mejora la protección en el sitio de infección, sino que también contribuye a la inmunidad de mayor duración y las tasas de transmisión potencialmente reducidas.
El creciente enfoque en el desarrollo de terapias genéticas inhaladas, anticuerpos monoclonales y vacunas para enfermedades respiratorias e infecciosas fortalece aún más el crecimiento del mercado, lo que lleva a una mayor investigación, aprobaciones regulatorias e interés comercial en biológicos inhalables.
- En enero de 2025, Ocugen, Inc. anunció que la FDA revisó y aceptó su nueva solicitud de fármaco en investigación para OCU500, una vacuna mucosa inhalada para Covid-19. El ensayo clínico de fase 1, patrocinado por el Instituto Nacional de Alergias y Enfermedades Infecciosas, evaluará la seguridad, la tolerabilidad y la inmunogenicidad de OCU500 administrada a través de la inhalación y como un aerosol nasal. La vacuna, basada en una nueva tecnología de chimpancé vectus por adenovirus, tiene como objetivo proporcionar una protección duradera contra Covid-19 y otras amenazas respiratorias.
Desafío del mercado
Desafíos de estabilidad y biodisponibilidad
Un desafío importante en el mercado biológico inhalable es garantizar la estabilidad, la biodisponibilidad y la entrega adecuada de fármacos biológicos cuando se administran por inhalación. A diferencia de los biológicos inyectables tradicionales, que están diseñados para la absorción directa del torrente sanguíneo, los productos biológicos inhalados deben atravesar múltiples capas de defensa en el sistema respiratorio, incluidos los pasajes nasales, la garganta y los pulmones.
Los fármacos biológicos, como las proteínas, los péptidos y los anticuerpos monoclonales, a menudo son más complejos y sensibles que los fármacos de moléculas pequeñas, lo que los hace propensos a la degradación debido a factores ambientales como la humedad, la temperatura y el estrés mecánico durante el proceso de inhalación.
Estas moléculas biológicas también enfrentan desafíos como la agregación o la desnaturalización, lo que puede comprometer su efectividad cuando se administra a través de la inhalación. Además, la formulación debe diseñarse para garantizar que el medicamento pueda alcanzar el objetivo previsto en los pulmones, liberar el ingrediente activo de manera eficiente y mantener su función terapéutica.
El proceso de inhalación también requiere una dosis precisa, ya que la dosis debe ser consistente y efectiva con cada administración. Se están desarrollando tecnologías de formulación avanzadas como secado por pulverización, liofilización y sistemas basados en nanopartículas para mejorar la estabilidad y la solubilidad de los medicamentos biológicos.
Además, se están introduciendo innovaciones de dispositivos como inhaladores diseñados para optimizar la entrega de productos biológicos a los pulmones.
Tendencia de mercado
Centrarse en la terapia génica y las terapias basadas en ARNm
El mercado está registrando tendencias significativas impulsadas por modalidades de tratamiento en evolución. Una tendencia clave es el enfoque creciente en la terapia génica inhalada para enfermedades respiratorias. Este enfoque tiene como objetivo administrar directamente genes terapéuticos a los pulmones, dirigidos a la causa raíz de enfermedades como la fibrosis quística y las afecciones respiratorias crónicas.
La terapia génica inhalada tiene el potencial de mejorar la función pulmonar, reducir la progresión de la enfermedad y ofrecer beneficios a largo plazo al abordar las anormalidades genéticas a nivel celular. El mecanismo de suministro objetivo evita los efectos secundarios sistémicos, proporcionando una opción de tratamiento más eficiente y localizada.
Otra tendencia prominente es el creciente interés en los productos biológicos inhalables basados en ARNm. Con el éxito de las tecnologías de ARNm en las vacunas, este enfoque se está expandiendo al espacio biológico inhalable. Las terapias de ARNm se pueden administrar directamente a los pulmones, lo que permite un tratamiento más rápido y efectivo para las enfermedades respiratorias.
Estas terapias ofrecen la ventaja de la administración no invasiva, los tiempos de respuesta rápidos y la capacidad de adaptarse rápidamente a las enfermedades emergentes, lo que las hace muy prometedoras para el tratamiento de una variedad de afecciones respiratorias.
- En febrero de 2025, Boehringer Ingelheim, IP Group, el consorcio de terapia de genes respiratorios del Reino Unido y Oxford Biomedica anunciaron el inicio de Lenticlair 1, un ensayo de fase I/II para BI 3720931, una terapia inhalada de género basado en el vector lentiviral para la fibrosis cística cística. La terapia tiene como objetivo administrar un gen de la regulador de conductancia transmembrana de fibrosis quística funcional (CFTR) a las células epiteliales de las vías respiratorias, ofreciendo un tratamiento potencial para pacientes con FQ que no pueden beneficiarse de los moduladores CFTR.
Instantáneo del mercado de biológicos inhalables
|
Segmentación
|
Detalles
|
|
Por tipo de producto
|
Proteínas y péptidos, anticuerpos monoclonales, vacunas, productos de terapia génica, otros
|
|
Por indicación
|
Enfermedades respiratorias, enfermedades infecciosas, diabetes, manejo del dolor, otros
|
|
Por dispositivo de entrega
|
Inhaladores de polvo seco, inhaladores de dosis medidas, nebulizadores, inhaladores de niebla suave
|
|
Por canal de distribución
|
Farmacias hospitalarias, farmacias minoristas, farmacias en línea
|
|
Por región
|
América del norte: Estados Unidos, Canadá, México
|
|
Europa: Francia, Reino Unido, España, Alemania, Italia, Rusia, resto de Europa
|
|
Asia-Pacífico: China, Japón, India, Australia, ASEAN, Corea del Sur, resto de Asia-Pacífico
|
|
Medio Oriente y África: Turquía, EAU, Arabia Saudita, Sudáfrica, resto de Medio Oriente y África
|
|
Sudamerica: Brasil, Argentina, resto de América del Sur
|
Segmentación de mercado
- Por tipo de producto (proteínas y péptidos, anticuerpos monoclonales, vacunas, productos de terapia génica y otros): el segmento de proteínas y péptidos ganó USD 939.8 millones en 2023, debido a su creciente adopción en terapias específicas, mejorado en formulaciones inhalables y la expansión de aplicaciones en desordenes respiratorios y metabólicos.
- Por indicación (enfermedades respiratorias, enfermedades infecciosas, diabetes, manejo del dolor y otros): el segmento de diabetes mantuvo una participación del mercado del mercado en 2023, debido a la creciente prevalencia de asma, EPOC y fibrosis cística, junto con avances en biológicos inhalables para un tratamiento localizado más efectivo.
- Por dispositivo de suministro (inhaladores de polvo seco, inhaladores de dosis medidas, nebulizadores e inhaladores de niebla suave): se proyecta que el segmento de inhaladores de polvo seco alcance los USD 4,278.2 millones en 2031, debido a su facilidad de uso, una mayor estabilidad del fármaco y una creciente preferencia de los dispositivos portátiles de inhalación sin propulsores.
- Por canal de distribución (farmacias hospitalarias, farmacias minoristas y farmacias en línea): se proyecta que el segmento de farmacias hospitalarias alcanza USD 4,721.7 millones para 2031, debido a la creciente administración de la administración de biológicos en entornos clínicos, al aumento de las visitas a los hospitales de los pacientes y la disponibilidad de terapias de inhalación especializadas.
Mercado de productos biológicos inhalablesAnálisis regional
Según la región, el mercado se ha clasificado en América del Norte, Europa, Asia Pacífico, Medio Oriente y África y América Latina.
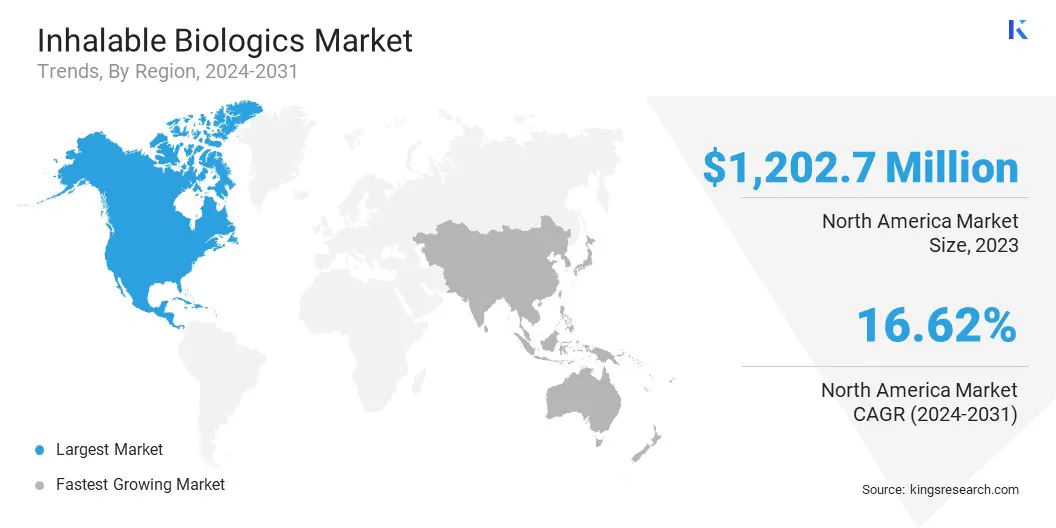
América del Norte representó una participación del 37.47% en el mercado de productos biológicos inhalables en 2023, con una valoración de USD 1.202.7 millones. Este dominio se atribuye a la fuerte industria biofarmacéutica de la región, extensas inversiones de I + D y la presencia de actores clave del mercado que impulsan la innovación en biológicos inhalables.
La infraestructura de salud avanzada, las altas tasas de adopción de nuevos sistemas de administración de medicamentos y marcos regulatorios de apoyo han acelerado aún más el crecimiento del mercado. Además, la creciente prevalencia de enfermedades respiratorias, junto con la creciente demanda de opciones de tratamiento no invasivas, ha contribuido significativamente a la expansión del mercado.
La región se beneficia de las instalaciones de investigación clínica bien establecidas y las colaboraciones entre compañías farmacéuticas e instituciones de investigación, facilitando el rápido desarrollo y comercialización de productos biológicos inhalables. Financiación del gobierno fuerte para los avances biotecnológicos, junto con una alta tasa de aprobaciones regulatorias para terapias biológicas innovadoras, fortalece aún más el crecimiento del mercado.
Además, la creciente adopción de la medicina personalizada y las terapias de precisión en la atención respiratoria ha estimulado la demanda de productos biológicos inhalables, posicionando a América del Norte como líder en esta industria en evolución.
Se espera que el mercado en Asia Pacífico registre el crecimiento más rápido, con una tasa compuesta anual proyectada de 17.22% durante el período de pronóstico. Esta rápida expansión se impulsa por el aumento de las inversiones en salud, el aumento de la conciencia de las terapias biológicas y la creciente carga de enfermedades respiratorias y crónicas en la región.
Las economías emergentes como China e India están registrando un fuerte crecimiento de la industria farmacéutica, lo que lleva a una mayor producción y adopción de productos biológicos inhalables. Además, las iniciativas gubernamentales para mejorar la accesibilidad de la atención médica, junto con la expansión de las capacidades de fabricación farmacéutica, están fomentando el desarrollo del mercado.
La creciente población geriátrica, el aumento de la prevalencia de asma y enfermedad pulmonar obstructiva crónica (EPOC), y la mejora de los marcos regulatorios está impulsando aún más la demanda de terapias avanzadas de inhalación. Además, la expansión de las redes de farmacia en línea y minorista, junto con un cambio hacia los enfoques de tratamiento centrados en el paciente, está posicionando a Asia Pacífico como un centro de crecimiento clave en el mercado.
- En diciembre de 2024, Cipla Limited anunció que recibió la aprobación regulatoria de la Organización de Control de Estándar de Medicamentos Centrales (CDSCO) para la distribución exclusiva y la comercialización del polvo de inhalación de Afrezza (insulina humana) en la India. Desarrollado y fabricado por Mannkind Corporation (EE. UU.), Afrezza es una insulina inhalada de acción rápida diseñada para mejorar el control glucémico en adultos con diabetes mellitus.
Marcos regulatorios
- En los EE. UU., los productos biológicos inhalables están regulados por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) bajo la Ley Federal de Alimentos, Drogas y Cosméticos (FDCA) y la Ley del Servicio de Salud Pública (PHSA). El Centro de Evaluación e Investigación de Drogas (CDER) supervisa los medicamentos inhalables de molécula pequeña, mientras que el Centro de Evaluación e Investigación Biológica (CBER) regula los complejos biológicos.
- En la Unión Europea (UE), los productos biológicos inhalables se encuentran bajo la Agencia Europea de Medicamentos (EMA) y deben cumplir con la regulación. El Comité de Medicamentos para el Uso Humano (CHMP) evalúa las aplicaciones de marketing presentadas a través del procedimiento centralizado. La farmacopea europea proporciona estándares de calidad específicos para formulaciones inhaladas, y los fabricantes deben adherirse a las buenas pautas de práctica de fabricación.
- En China, La Administración Nacional de Productos Médicos (NMPA) regula los productos biológicos inhalables bajo la ley de la Administración de Medicamentos. El Centro para la Evaluación de Drogas (CDE) supervisa las aprobaciones de ensayos clínicos, que requiere el cumplimiento de los buenos estándares de práctica clínica. Los productos biológicos también deben cumplir con los estándares de farmacopea china para formulaciones de drogas inhaladas.
- En Japón, los productos biológicos inhalables están regulados por los productos farmacéuticos yDispositivos médicosAgencia (PMDA) bajo la Ley de Farmacéuticos y Dispositivos Médicos (Ley PMD). La aprobación requiere la adherencia a los estándares de farmacopea japoneses, una buena práctica clínica y una buena práctica de fabricación (GMP).
- En la India, La Organización de Control de Estándar de Medicamentos Centrales (CDSCO) regula los productos biológicos inhalables bajo la Ley de Drogas y Cosméticos, 1940. El controlador general de drogas General de la India (DCGI) evalúa las aplicaciones de ensayos clínicos, mientras que la Comisión de Farmacopeo de la India (IPC) establece estándares de calidad para formulaciones inhalables.
Panorama competitivo
La industria biológica inhalable se caracteriza por una rápida innovación, colaboraciones estratégicas y un aumento de las inversiones en tecnologías avanzadas de administración de medicamentos. Los actores clave del mercado se centran en desarrollar nuevas formulaciones de inhalación para productos biológicos, aprovechando las plataformas patentadas para mejorar la estabilidad del fármaco, la biodisponibilidad y el suministro pulmonar dirigido.
La expansión a nuevas áreas terapéuticas más allá de las enfermedades respiratorias es una estrategia central, con esfuerzos continuos para adaptar los productos biológicos inhalables para condiciones sistémicas. Las empresas también están priorizando las aprobaciones regulatorias y los ensayos clínicos para acelerar la entrada al mercado y fortalecer sus carteras.
Este mercado está conformado por iniciativas estratégicas destinadas a mantener una fuerte presencia en el mercado. Las empresas participan activamente en fusiones y adquisiciones para mejorar las capacidades de investigación, expandir las tuberías de productos y acelerar la comercialización. Las colaboraciones con los fabricantes de dispositivos juegan un papel crucial en la optimización de los sistemas de inhalación para las formulaciones biológicas, asegurando la eficiencia y el cumplimiento del paciente.
Las inversiones continuas en aerosol de próxima generación y tecnologías basadas en nanopartículas están llevando a avances en la deposición y absorción de drogas. Además, las empresas están ampliando su alcance geográfico a través de asociaciones con distribuidores regionales, lo que permite una penetración más amplia del mercado. Las inversiones en I + D siguen siendo un enfoque clave, fomentando la innovación sostenida y el desarrollo de productos biológicos inhalables de vanguardia.
- En marzo de 2025, Kenox Pharmaceuticals Inc. y Lactiga US, Inc. anunciaron una colaboración estratégica para avanzar en las terapias secretoras de IgA (SIGA) dirigidas a la mucosa para pacientes inmunodeficientes. La asociación tiene como objetivo acelerar el desarrollo preclínico de nuevas terapias que mejoran la inmunidad de la mucosa. Los productos farmacéuticos de Kenox aprovechan su experiencia en sistemas de suministro biológico nasal e inhalado para apoyar la plataforma SIGA Technology de Lactiga, abordando una necesidad médica insatisfecha de terapia SIGA intranasal en pacientes inmunodeficientes.
Lista de empresas clave en el mercado de biológicos inhalables:
- Astrazeneca
- Mannkind Corporation
- SYNAIRGEN PLC.
- Pulmocida
- Aerogen Ltd
- Liquidia Corporation
- Corporación de Nephron Pharmaceuticals
- Incarda Therapeutics, Inc.
- Agumab Therapeutics
- Acu-flujo limitado
- Recode terapéutica
- Aatec Medical GmbH
- Avalyn Pharma Inc.
- Biotecnología de vero
- SPEXIS LTD.
Desarrollos recientes (M&A/Partnerships/Accesions/Productsings)
- En enero de 2025, Ethris GmbH anunció resultados positivos de fase 1 para ETH47, una terapia nasal basada en ARNm para el asma no controlada. ETH47 mostró la expresión de interferón lambda (IFNλ) dependiente de la dosis, lo que confirma el compromiso objetivo sin eventos adversos graves. Ethris planea comenzar un ensayo de fase 2A en el segundo trimestre de 2025 para evaluar el efecto de Eth47 sobre los síntomas del asma después de la infección por rinovirus.
- En noviembre de 2024, Alvéogene recibió una designación rara de enfermedad pediátrica de la FDA de EE. UU. Para AVG-002, su nueva terapia génica inhalada para la deficiencia de proteína B tensioactiva neonatal letal B. AVG-002, desarrollado utilizando la plataforma de ingenio, ofrece un gen SP-B funcional directamente al pulmón neonatal a través de la instilación respiratoria. Los datos preclínicos sugieren que una sola administración podría proporcionar un tratamiento para toda la vida.
- En octubre de 2024, Kither Biotech anunció el inicio de un estudio clínico de fase 1 para Kit2014, una nueva terapia de péptidos inhalados para la fibrosis quística. Kit2014 está diseñado como un tratamiento adicional para los moduladores CFTR existentes, mejorando la función CFTR, promoviendo la broncodilatación y reduciendo la inflamación a través de la inhibición de PDE3/4. El estudio evaluará la seguridad, la tolerabilidad y la farmacocinética de KIT2014 en voluntarios adultos sanos.


