規制問題アウトソーシング市場
規制業務のアウトソーシング市場規模、シェア、成長と業界の分析、サービス別(規制コンサルティング、法定代理人、提出の準備と管理、品質とコンプライアンス、その他)、アプリケーション、エンドユーザー(医薬品およびバイオテクノロジー企業、医療機器メーカー)、地域分析、地域分析 2024-2031
ページ: 190 | 基準年: 2023 | リリース: January 2025 | 著者: Sunanda G. | 最終更新: July 2025
今すぐお問い合わせ
ページ: 190 | 基準年: 2023 | リリース: January 2025 | 著者: Sunanda G. | 最終更新: July 2025
規制問題のアウトソーシングとは、一般的に医薬品、バイオテクノロジー、医療機器、ヘルスケアなどの業界で、規制コンプライアンスタスクをサードパーティのサービスプロバイダーに委任する実践を指します。
このアプローチには、規制戦略開発の管理、ドキュメントの準備、製品承認のためのアプリケーションの提出、コンプライアンス監視、および市場後の監視が含まれます。これにより、組織は、多様なグローバル市場全体のコンプライアンスを効率的に確保しながら、研究開発などの中核活動に焦点を当てることができます。
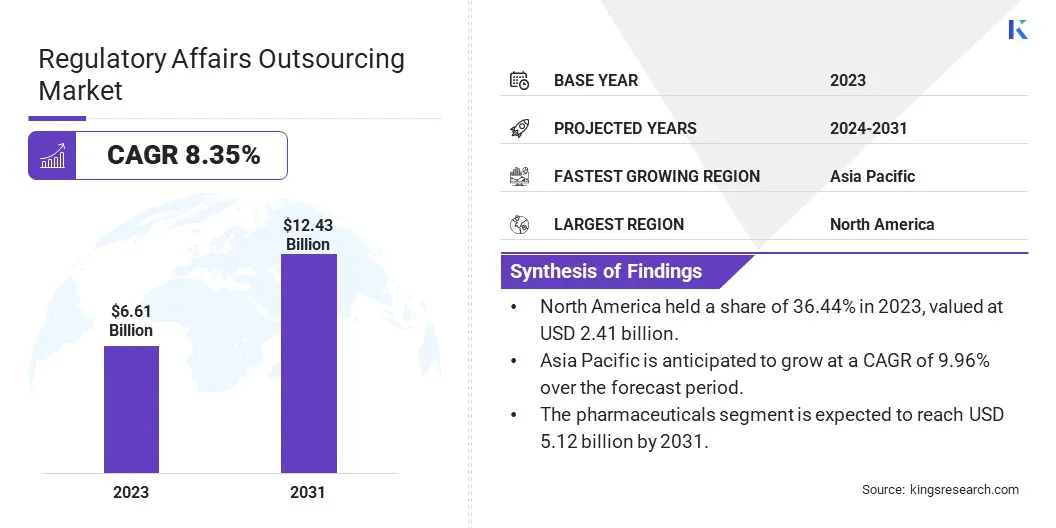
世界の規制業務アウトソーシング市場規模は、2023年に66億1,000万米ドルと評価され、2024年の709億米ドルから2031年までに124億3,000万米ドルに成長すると予測されており、予測期間中は8.35%のCAGRを示しています。
市場は、グローバルな規制枠組みの複雑さの増加と、費用対効果の高いコンプライアンスソリューションの需要の高まりによって促進されています。さらに、臨床試験の拡大、高度な治療薬の上昇、および市場後の監視後のさらなる燃料市場の拡大への焦点の拡大。
グローバルな規制業務アウトソーシング市場で事業を展開する大手企業は、Accell Clinical Research、LLC、LLC、GenPact、Wuxi Apptec、Medpace、Charles River Laboratories、Criterium、Inc。、Iuvo Bioscience、LLC、Covance、Freyr、Icon PLC、Pharmalex Gmbh。 Thermo Fisher Scientific Inc.(PPD)、その他。
アウトソーシング規制問題の機能は、市場の成長を促進する品質とコンプライアンスへの焦点の高まりに貢献します。規制機関は、特に医療や医薬品などの高度に規制された産業で、安全性と品質基準に重点を置いています。
マーケットドライバー
「世界的に臨床試験の数が増えている」
世界中の臨床試験の増加は、規制問題のアウトソーシング市場の成長を促進しています。イノベーションと新しい治療法の開発に焦点を当てているため、世界的に行われた臨床試験の数が増加しています。
承認の取得、現地の規制の遵守の確保、必要な文書の提出など、これらの試験の規制側の側面を管理することは、複雑で時間型の時間型です。
アウトソーシングパートナーは、グローバルな規制要件の専門知識を備えた、承認プロセスを合理化し、遅延を削減し、必要な規制基準に従って臨床試験が実施されるようにします。臨床試験での規制支援に対するこの需要の増加は、市場の拡大をさらに促進します。
市場の課題
「複数の地域での規制コンプライアンスへの取り組み」
規制問題のアウトソーシング市場の成長を抑制する重要な要因は、複数の地域でさまざまな規制要件に順守するという課題です。グローバル市場は、規制、文書基準、承認のタイムラインに大きな違いを示し、外部委託されたサービスプロバイダーに複雑さを生み出します。
この変動性は、遅延、エラー、および潜在的なコンプライアンスの潜在的なコンプライアンスのリスクを高め、外部委託された運用の効率と有効性に影響を与えます。
この課題に対処するために、企業は高度なデジタルツールをますます採用しています人工知能(AI)規制プロセスを合理化し、ドキュメントの正確性を確保します。 AIを搭載したプラットフォームを活用すると、リアルタイムの更新と予測分析を提供することにより、プロバイダーが規制の変化に適応することができます。
さらに、企業は、地元のチームを設立したり、市場の専門家とのパートナーシップを設立したりして、規制環境をより効果的にナビゲートすることにより、地域固有の専門知識に投資しています。これらのアプローチは、適応性を高め、コンプライアンスリスクを最小限に抑え、サービス提供を改善し、市場の成長に対する規制の複雑さの影響を軽減します。
市場動向
「規制のアウトソーシングは、デジタルヘルストレンドとともに上昇します」
モバイルヘルスアプリ、ウェアラブル、遠隔医療ソリューションなどのデジタルヘルス製品とサービスの急速な拡大は、規制問題のアウトソーシング市場の成長に貢献しています。規制機関は、デジタルヘルスイノベーションによってもたらされる独自の課題に対処するための新しいフレームワークを開発しています。
これらの製品は、データプライバシーの懸念、サイバーセキュリティ基準、新しい臨床試験要件など、規制のコンプライアンスに対する異なるアプローチを必要とすることがよくあります。
デジタルヘルスソリューションを開発している企業は、進化する規制をナビゲートするために、この分野の専門知識を備えたアウトソーシング企業に目を向けています
| セグメンテーション | 詳細 |
| サービスによって | 規制コンサルティング、法定代理人、提出の準備と管理、品質とコンプライアンス、その他 |
| アプリケーションによって | 医薬品、医療機器、生物学、その他 |
| エンドユーザーによる | 製薬およびバイオテクノロジー企業、医療機器メーカー、契約研究機関(CRO) |
| 地域別 | 北米:米国、カナダ、メキシコ |
| ヨーロッパ:フランス、英国、スペイン、ドイツ、イタリア、ロシア、ヨーロッパのその他 | |
| アジア太平洋地域:中国、日本、インド、オーストラリア、ASEAN、韓国、アジア太平洋地域の残り | |
| 中東とアフリカ:トルコ、アラブ首長国連邦、サウジアラビア、南アフリカ、中東の残りのアフリカ | |
| 南アメリカ:ブラジル、アルゼンチン、南アメリカの残り |
地域に基づいて、グローバル市場は北米、ヨーロッパ、アジア太平洋、中東、アフリカ、ラテンアメリカに分類されています。

北米の規制業務アウトソーシング市場は、2023年に約36.44%の顕著なシェアを占めており、24億1,000万米ドルの価値がありました。この地域の確立された製薬およびバイオテクノロジー産業は、この拡大を推進しています。薬物承認の増加、臨床試験、そして治療法の継続的な革新には、複雑な承認プロセスをナビゲートするために専門家の規制サービスが必要です。
企業がFDAのような厳しい規制要件を満たしている一方で、製品開発のタイムラインを加速すると、専門的な規制問題のアウトソーシングの需要が増加しています
アジア太平洋地域は、予測期間にわたって9.96%の最速CAGRで成長すると予測されています。アジア太平洋地域の医薬品およびバイオテクノロジー部門は、R&D投資の増加、バイオ医薬品の進歩、および拡大する医療市場に支えられて、急速な成長を経験しています。
この地域には、バイオテクノロジーと製薬会社の数が増えているため、規制の専門知識に対する需要が高まっています。
アウトソーシング規制問題により、これらの企業は地方および国際的な規制の複雑さを管理し、革新的な薬物や治療法を市場に導入する能力を向上させ、それによって競争力のあるポジショニングを強化することができます。
グローバルな規制業務アウトソーシング市場は、確立された企業と上昇組織の両方を含む多くの参加者によって特徴付けられています。 市場の主要なプレーヤーは、非営利のメンバーシップ協会、契約研究機関(CRO)、テクノロジープロバイダー、バイオ医薬品企業など、さまざまな利害関係者とのパートナーシップやコラボレーションにますます注力しています。これらのコラボレーションは、規制プロセスを合理化し、コンプライアンス機能を強化し、効率的なデータ管理のための高度なテクノロジーを活用することを目的としています。
非営利団体と連携することにより、企業は業界の洞察と政策擁護にアクセスし、CROとのパートナーシップにより、臨床試験管理と規制の提出の専門知識が可能になります。
最近の開発
よくある質問