Определение рынка
Система управления клиническими исследованиями (CTMS) — это специализированная программная платформа, предназначенная для облегчения планирования, проведения и контроля клинических исследований, обеспечивая при этом соблюдение нормативных требований.
Рынок охватывает программное обеспечение и услуги, которые поддерживают планирование клинических исследований, составление бюджета, управление площадками, отслеживание участников и составление отчетов. Он включает в себя облачные и локальные платформы, используемые фармацевтическими компаниями, контрактными исследовательскими организациями и академическими учреждениями.
В отчете представлен обзор основных факторов роста, подкрепленный региональным анализом и нормативной базой, которая, как ожидается, повлияет на развитие рынка в течение прогнозируемого периода.
Рынок систем управления клиническими исследованиямиОбзор
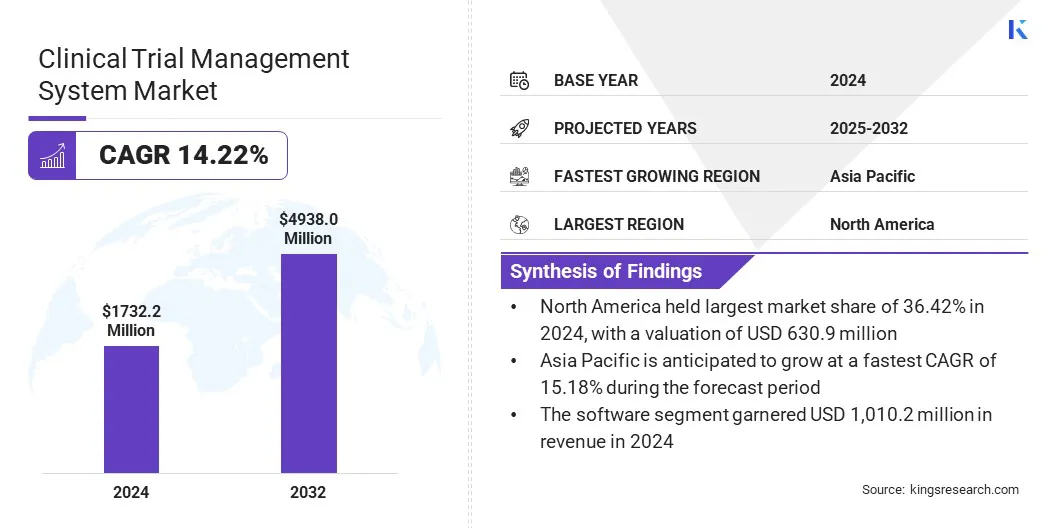
По данным Kings Research, объем мирового рынка систем управления клиническими исследованиями оценивался в 1 732,2 миллиона долларов США в 2024 году и, согласно прогнозам, вырастет с 1 946,5 миллиона долларов США в 2025 году до 4 938,0 миллионов долларов США к 2032 году, демонстрируя среднегодовой темп роста 14,22% в течение прогнозируемого периода.
Рынок переживает устойчивый рост, обусловленный увеличением количества клинических испытаний и усложнением протоколов испытаний. Растущее внедрение цифровых платформ фармацевтическими и биотехнологическими компаниями для оптимизации исследовательских операций и обеспечения соблюдения нормативных требований вносит значительный вклад в расширение рынка.
Основными компаниями, работающими в отрасли систем управления клиническими исследованиями, являются Oracle, IQVIA, Veeva Systems Inc., Dassault Systèmes, RealTime Software Solutions, LLC, CIOCoverage, PHARMASEAL, Wipro, Castor, Salesforce, Inc., Advarra, Cloudbyz, Fortrea, SimpleTrials и Clario.
Ключевые показатели рынка:
- Объем рынка систем управления клиническими исследованиями в 2024 году оценивался в 1 732,2 миллиона долларов США.
- Прогнозируется, что рынок будет расти в среднем на 14,22% с 2025 по 2032 год.
- В 2024 году доля рынка Северной Америки составляла 36,42% при оценке 630,9 млн долларов США.
- Сегмент программного обеспечения в 2024 году получил выручку в размере 1 010,2 млн долларов США.
- Ожидается, что к 2032 году сегмент on-premise достигнет 2 733,0 млн долларов США.
- Ожидается, что к 2032 году сегмент фармацевтических и биофармацевтических компаний достигнет 2 297,4 млн долларов США.
- Ожидается, что рынок в Азиатско-Тихоокеанском регионе будет расти в среднем на 15,18% в течение прогнозируемого периода.
Переход к децентрализованным исследованиям и растущая потребность в доступе к данным в режиме реального времени стимулируют внедрение облачных решений CTMS. Эти платформы обеспечивают гибкость, масштабируемость и улучшенное сотрудничество между распределенными исследовательскими площадками, хорошо согласуясь с развивающимися моделями испытаний.
Использование облачных решений CTMS способствует росту рынка за счет улучшения управления данными, ускорения рабочих процессов и поддержки децентрализованных пробных операций.
- В апреле 2025 года Veeva Systems представила Veeva SiteVault CTMS, облачную систему управления клиническими исследованиями для исследовательских центров. Решение интегрируется с SiteVault eISF и SiteVault eConsent, обеспечивая комплексное управление исследованиями на единой платформе. Он также обеспечивает бесперебойный двунаправленный поток данных со спонсорами через клиническую платформу Veeva, что позволяет сократить количество ручных процессов и повысить эффективность работы сайта.
Доступ к данным в реальном времени и управление объектами способствуют внедрению CTMS
Рынок переживает устойчивый рост из-за растущей потребности в доступе к данным в реальном времени и эффективном управлении сайтами. Растущая сложность и глобальное расширение клинических исследований приводит к необходимости уделять приоритетное внимание эффективному надзору.
Спонсорам и контрактным исследовательским организациям требуется прозрачность в режиме реального времени ключевых показателей эффективности, таких как набор пациентов, производительность учреждения, соблюдение протоколов и отчетность о нежелательных явлениях, чтобы повысить операционную эффективность и обеспечить соответствие нормативным требованиям. Доступ в режиме реального времени к оперативным и клиническим данным способствует более быстрому принятию решений, сокращает задержки и улучшает общее выполнение исследования.
- В феврале 2025 года Inovalon запустила систему поиска пациентов для клинических исследований — решение на базе искусственного интеллекта, которое интегрируется с электронными медицинскими записями (EHR) и позволяет в режиме реального времени идентифицировать пациентов, подходящих для клинических исследований. Разработанный для сокращения задержек с набором персонала и административной нагрузки, этот инструмент автоматизирует предварительный отбор на основе критериев, специфичных для исследования, и соединяет спонсоров с готовыми к исследованиям сайтами через исследовательскую сеть Inovalon.
Это развитие согласуется с растущим спросом на доступ к данным в реальном времени и упрощенную координацию объектов. Это отражает продолжающийся переход к пробным операциям на основе данных и эффективному выполнению, что способствует внедрению платформ CTMS.
Фрагментированные системы среди CRO, спонсоров и испытательных площадок
Ключевой проблемой на рынке систем управления клиническими исследованиями является фрагментация технологических платформ между контрактными исследовательскими организациями (CRO), спонсорами и местами проведения испытаний. Эта фрагментация приводит к разрозненности данных, противоречивым рабочим процессам и коммуникационным барьерам, которые препятствуют сотрудничеству и задерживают проведение испытаний.
Отсутствие совместимости между различными программными системами приводит к дублированию задач, увеличению административных расходов и проблемам в управлении цепочками поставок. Такая неэффективность негативно влияет на сроки, качество данных и соблюдение нормативных требований.
Чтобы решить эту проблему, поставщики внедряют независимые от поставщика решения CTMS, которые обеспечивают плавную интеграцию с несколькими сторонними платформами. Эта интеграция облегчает централизованное управление данными и унифицированные рабочие процессы, объединяя всех заинтересованных сторон в автоматизированном процессе цепочки поставок, тем самым повышая эффективность испытаний и снижая операционные риски.
- В июне 2025 года компания Oracle представила новые улучшения совместимости своего решения по рандомизации и управлению поставками для исследований (RTSM), позволяющие автоматизировать управление поставками лекарств и объединение запасов между многочисленными клиническими исследованиями и поставщиками. Обновление поддерживает интеграцию с такими системами, как SAP (логистика), Almac (клиническое снабжение) и Catalent (производство лекарств), с целью снижения неэффективности, ускорения сроков испытаний и улучшения использования ресурсов посредством унифицированной и независимой от поставщика платформы.
Интеграция CTMS с передовыми платформами данных и искусственным интеллектом
Ключевой тенденцией на рынке CTMS является интеграция решений для клинических исследований с передовыми платформами данных и технологиями искусственного интеллекта (ИИ). Такая интеграция позволяет беспрепятственно агрегировать, анализировать и управлять обширными клиническими данными из нескольких источников, повышая точность и доступность данных. Инструменты на базе искусственного интеллекта улучшают прогнозную аналитику, оценку рисков иавтоматизация рабочих процессов, что приводит к лучшему набору пациентов, мониторингу и общей эффективности исследования.
- В июне 2024 года Medidata запустила Clinical Data Studio, единую платформу, предназначенную для ускорения анализа и сверки данных клинических исследований за счет интеграции данных из источников Medidata и источников, не принадлежащих Medidata. Используя встроенный искусственный интеллект, это решение обеспечивает более быстрое обнаружение аномалий, управление качеством на основе рисков и аналитику в режиме реального времени, помогая спонсорам и исследовательским группам оптимизировать рабочие процессы с данными и улучшить проведение испытаний.
Обзор рынка систем управления клиническими исследованиями
|
Сегментация
|
Подробности
|
|
По компоненту
|
Программное обеспечение, Услуги
|
|
По способу доставки
|
На базе Интернета и облака, локально
|
|
Конечным пользователем
|
Фармацевтические и биофармацевтические компании, производители медицинского оборудования и другие
|
|
По регионам
|
Северная Америка: США, Канада, Мексика
|
|
Европа: Франция, Великобритания, Испания, Германия, Италия, Россия, Остальная Европа.
|
|
Азиатско-Тихоокеанский регион: Китай, Япония, Индия, Австралия, АСЕАН, Южная Корея, остальные страны Азиатско-Тихоокеанского региона.
|
|
Ближний Восток и Африка: Турция, ОАЭ, Саудовская Аравия, Южная Африка, остальной Ближний Восток и Африка.
|
|
Южная Америка: Бразилия, Аргентина, остальная часть Южной Америки.
|
Сегментация рынка
- По компонентам (программное обеспечение и услуги). В 2024 году сегмент программного обеспечения заработал 1 010,2 миллиона долларов США из-за растущей потребности в централизованном надзоре за испытаниями и возможностях интеграции данных.
- По способу доставки (на базе Интернета, в облаке и внутри помещения): сегмент локальных решений занимал 57,36% рынка в 2024 году из-за предпочтения внутреннего контроля данных и соблюдения институциональных ИТ-политик.
- По конечному пользователю (фармацевтические и биофармацевтические компании, производители медицинского оборудования и другие): прогнозируется, что к 2032 году сегмент фармацевтических и биофармацевтических компаний достигнет 2 297,4 млн долларов США из-за большого объема клинических исследований и спроса на эффективные системы управления исследованиями.
Рынок систем управления клиническими исследованиямиРегиональный анализ
В зависимости от региона рынок подразделяется на Северную Америку, Европу, Азиатско-Тихоокеанский регион, Ближний Восток и Африку и Южную Америку.
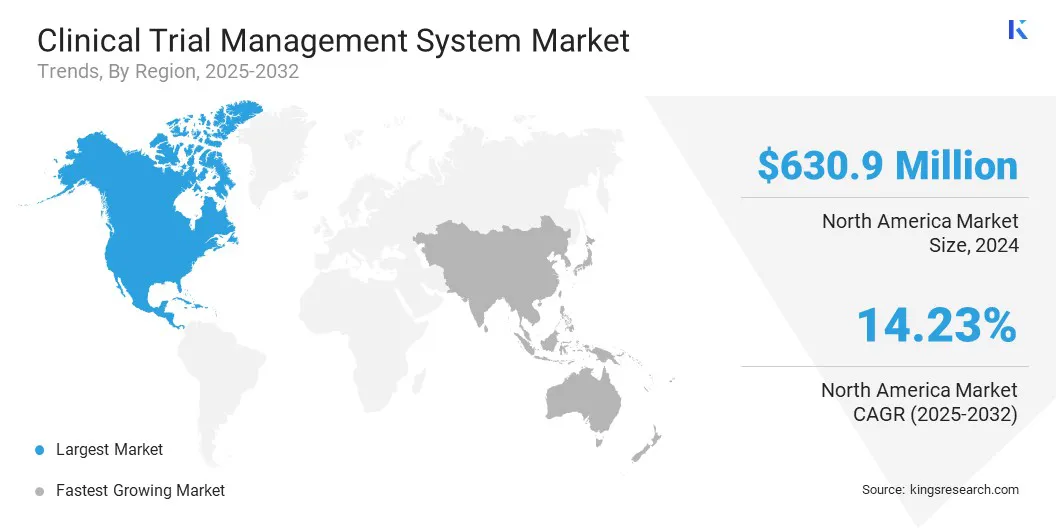
В 2024 году на долю Северной Америки пришлось 36,42% рынка систем управления клиническими исследованиями с оценкой 630,9 млн долларов США. Доминирование региона объясняется большим объемом текущих клинических исследований. Например, данные Всемирной организации здравоохранения показывают, что в США было зарегистрировано 7008 исследований.
Этому также способствует активное присутствие крупных фармацевтических компаний и контрактных исследовательских организаций, которые активно внедряют передовые цифровые платформы для оптимизации клинических испытаний. Кроме того, наличие академических медицинских центров и исследовательских университетов, занимающихся клиническими разработками, способствует устойчивому спросу на надежные системы управления исследованиями.
Ожидается, что в отрасли систем управления клиническими исследованиями в Азиатско-Тихоокеанском регионе будет зафиксирован самый быстрый рост на рынке: прогнозируемый среднегодовой темп роста составит 15,18 % в течение прогнозируемого периода. Этот рост поддерживается растущим использованием цифровых систем для улучшения испытательных операций и координации.
Например, в Австралии,Здоровье Нового Южного Уэльсавнедрила централизованную систему управления клиническими исследованиями во всех организациях общественного здравоохранения. Платформа служит общей онлайн-средой для оптимизации финансового управления, отслеживания участников, прогнозирования и отчетности, тем самым повышая эффективность проведения клинических исследований в регионе.
Кроме того, растущее присутствие транснациональных фармацевтических компаний в регионе усилило потребность в надежной инфраструктуре CTMS.
Эти фирмы все чаще передают клинические исследования фазы II и III в Азиатско-Тихоокеанский регион, чтобы получить выгоду от экономической эффективности, более быстрого набора пациентов и доступа к различным группам населения. Это создало высокий спрос на масштабируемые решения CTMS, соответствующие региональным нормативным стандартам и операционным сложностям.
Нормативно-правовая база
- В СШАУправление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) регулирует клинические испытания, чтобы обеспечить их разработку, проведение и отчетность в соответствии с федеральными правилами и стандартами надлежащей клинической практики (GCP).
- В ЯпонииРегулирующим органом клинических испытаний является Агентство по фармацевтике и медицинскому оборудованию (PMDA), которое действует при Министерстве здравоохранения, труда и социального обеспечения (MHLW). PMDA отвечает за рассмотрение заявок на клинические исследования, обеспечение их научной обоснованности и этических стандартов, а также мониторинг послепродажной безопасности.
Конкурентная среда
Рынок систем управления клиническими исследованиями характеризуется постоянным технологическим прогрессом, интеграцией платформ и стратегической консолидацией участников. Ключевые игроки сосредоточены на расширении возможностей решений за счет разработки модульных, совместимых платформ, которые поддерживают сложные рабочие процессы испытаний.
- В январе 2025 года Advarra представила свое решение для сотрудничества в исследованиях, направленное на оптимизацию запуска клинических исследований. Платформа объединяет автоматизированные рабочие процессы, видимость в реальном времени и единый вход для оптимизации таких процессов, как активация сайта, обмен документами, обучение на сайте и планирование регистрации. Он объединяет существующие технологические активы для сокращения дублирования, улучшения соответствия требованиям и поддержки более быстрого выполнения исследований в сетях спонсоров, CRO и сайтов.
Этот запуск отражает более широкий стратегический сдвиг среди поставщиков в сторону предоставления интегрированных комплексных решений, устраняющих операционную неэффективность, особенно на этапе запуска.
Кроме того, компании все чаще инвестируют в облачные архитектуры и аналитику в реальном времени для поддержки децентрализованных и гибридных моделей испытаний. Эти стратегии формируют конкурентную среду, определяемую функциональностью, глубиной интеграции и операционной эффективностью.
Ключевые компании на рынке систем управления клиническими исследованиями:
- Оракул
- ИКВИА
- Веева Системс Инк.
- Дассо Системс
- ООО «РеалТайм Программные Решения»
- Охват CIOC
- ФАРМАСИЛ
- Випро
- Кастор
- Сейлфорс, Инк.
- Адварра
- Cloudbyz
- Фортреа
- Простые испытания
- Кларио
Последние разработки (запуск продуктов)
- В апреле 2025 г., BSI Life Sciences выпустила версию BSI CTMS/eTMF 25.1, в которой представлены расширенные возможности настройки, новый спонсорский портал, динамические анкеты для мониторинга и обновленный портал технико-экономического обоснования. Обновление направлено на оптимизацию мониторинга центров, улучшение надзора и сокращение рабочей нагрузки CRA в рабочих процессах клинических исследований в Европе и Северной Америке.
- В марте 2025 г.Компания Jeeva Clinical Trials запустила программу партнерства CRO, чтобы ускорить проведение клинических испытаний нового поколения с помощью единой системы управления клиническими исследованиями на основе искусственного интеллекта. Инициатива направлена на поддержку CRO, специализирующихся на ожирении, дерматологии, онкологии и редких заболеваниях, путем повышения эффективности исследований, соблюдения требований и удержания пациентов с помощью инструментов совместной работы в реальном времени и автоматизированных рабочих процессов.


