多発性骨髄腫市場
多発性骨髄腫の市場規模、株式、成長、産業分析、薬物クラス(免疫調節薬、プロテアソーム阻害剤、その他)、治療タイプ(化学療法、標的療法、免疫療法、その他の治療)、疾患タイプ、投与経路、流通チャネル、地域分析別、および地域分析別、 2024-2031
ページ: 250 | 基準年: 2023 | リリース: May 2025 | 著者: Versha V. | 最終更新: February 2026
今すぐお問い合わせ
ページ: 250 | 基準年: 2023 | リリース: May 2025 | 著者: Versha V. | 最終更新: February 2026
市場とは、血液がんの一種である多発性骨髄腫の治療を目的とした治療の研究、開発、承認、商業化、分布、および販売を含む世界的な経済状況を指します。この市場には、製薬会社、バイオテクノロジー企業、医療提供者、規制機関、および支払人が含まれます。
薬物療法、診断、臨床試験、価格設定戦略、払い戻しモデル、市場アクセスイニシアチブにまたがっています。このレポートは、詳細な地域分析と市場のダイナミクスに影響を与える競争力のある景観とともに、市場を推進する主な要因の徹底的な評価を提供します。
世界の多発性骨髄腫市場規模は2023年に2,320億米ドルと評価され、2024年の2517億米ドルから2031年までに4,482億米ドルに成長すると予測されており、予測期間中は8.59%のCAGRを示しています。
市場は、世界的な発生率の上昇、老人人口の増加、診断技術の進歩に起因する着実な成長を登録しています。重要なR&D投資と、免疫調節因子、モノクローナル抗体、CAR-T細胞療法などの革新的な療法の導入は、治療効果と生存結果を高めています。
多発性骨髄腫業界で事業を展開している大手企業は、ジョンソン&ジョンソンサービス、インク、ブリストルマイヤーズスクイブカンパニー、GSK PLC。、ノバルティスAG、アムジェン社、アムジェン社、ファイザー社、サノフィ、アッバビー、アッバビー社、レジェンドバイオテク、アルセルクス、ヘーマーギックスLtd.、カリフアム、カリダム、oncpeptide ab、f. Takeda Pharmaceutical Company Limited。
さらに、ゲノミクスや精密医療などの高度な技術の統合により、よりパーソナライズされた治療アプローチが可能になり、患者の転帰が向上します。新しい治療薬と支持ケア薬の拡大するパイプラインは、市場のダイナミズムに貢献しています。

マーケットドライバー
不適格な多発性骨髄腫患者の治療オプションの拡大
幹細胞移植の資格がない多発性骨髄腫の患者に対する革新的な治療法の増加は、市場を推進しています。これらの患者は、多くの場合、処置を受けないようにする他の健康状態で、多くの場合、病気を効果的に管理できる代替治療オプションを必要とします。
併用治療を含む標的療法の開発は、これらの患者の生存率を高め、市場の拡大を支援しています。この特定の患者グループの治療へのアクセスと結果の改善は、他の方法では限られた選択肢を持つ人がより多くの治療オプションを利用できるようになるため、市場全体の成長に役立ちます。
市場の課題
再発または難治性多発性骨髄腫の制限された治療オプション
多発性骨髄腫市場における主要な課題は、再発または難治性多発性骨髄腫の患者に対する治療オプションが限られていることです。治療の進歩にもかかわらず、多発性骨髄腫は依然として不治の疾患であり、ほとんどの患者は最終的に再発を経験します。
病気が初期治療に難治性になると、標準的な治療法に対する反応が少なくなることが多いため、管理が難しくなります。これにより、患者の転帰に悪影響を与える可能性のある効果的な治療の代替品を提供することがますます困難になります。多発性骨髄腫の耐性を標的とする新規療法の開発は、この課題に対処しています。
さらに、臨床試験と進行中の研究は、進行性多発性骨髄腫患者が利用できる治療オプションを拡大するための新しい治療アプローチを特定して評価する上で重要です。
市場動向
多発性骨髄腫治療におけるモノクローナル抗体の採用の増加
多発性骨髄腫治療におけるモノクローナル抗体の採用の拡大は、治療環境を再構築しています。モノクローナル抗体は、骨髄腫細胞上の特定のタンパク質を標的とするように設計されており、免疫系が疾患をより効率的に戦うのを助けます。
臨床試験の成功と規制当局の承認にサポートされているこれらの治療法は、従来の治療と比較して改善された結果を提供します。彼らは、従来の治療、患者の転帰の改善、疾患の進行の減少、生存率の向上と比較して、より正確で毒性の低いアプローチを提供します。
これらの治療法が標準的な治療プロトコルにより統合され、疾患のさまざまな段階でより多くの治療オプションを提供するにつれて、市場は拡大し続けています。
|
セグメンテーション |
詳細 |
|
薬物クラスによって |
免疫調節薬(IMIDS)、プロテアソーム阻害剤、モノクローナル抗体、二重特異性抗体、CAR T細胞療法、化学療法剤、コルチコステロイドなど |
|
治療タイプによる |
化学療法、標的療法、免疫療法、幹細胞移植、放射線療法、その他の治療 |
|
病気の種類によって |
活動性多発性骨髄腫、くすぶって多発性骨髄腫(SMM) |
|
管理ルートごと |
経口、非経口(静脈内/注射可能) |
|
流通チャネルによる |
病院の薬局、小売薬局およびドラッグストア、オンライン薬局 |
|
地域別 |
北米:米国、カナダ、メキシコ |
|
ヨーロッパ:フランス、英国、スペイン、ドイツ、イタリア、ロシア、ヨーロッパのその他 | |
|
アジア太平洋:中国、日本、インド、オーストラリア、ASEAN、韓国、アジア太平洋地域の残り | |
|
中東とアフリカ:トルコ、U.A.E。、サウジアラビア、南アフリカ、中東の残りの部分とアフリカ | |
|
南アメリカ:ブラジル、アルゼンチン、南アメリカの残り |
市場セグメンテーション
地域に基づいて、市場は北米、ヨーロッパ、アジア太平洋、中東、アフリカ、南アメリカに分類されています。
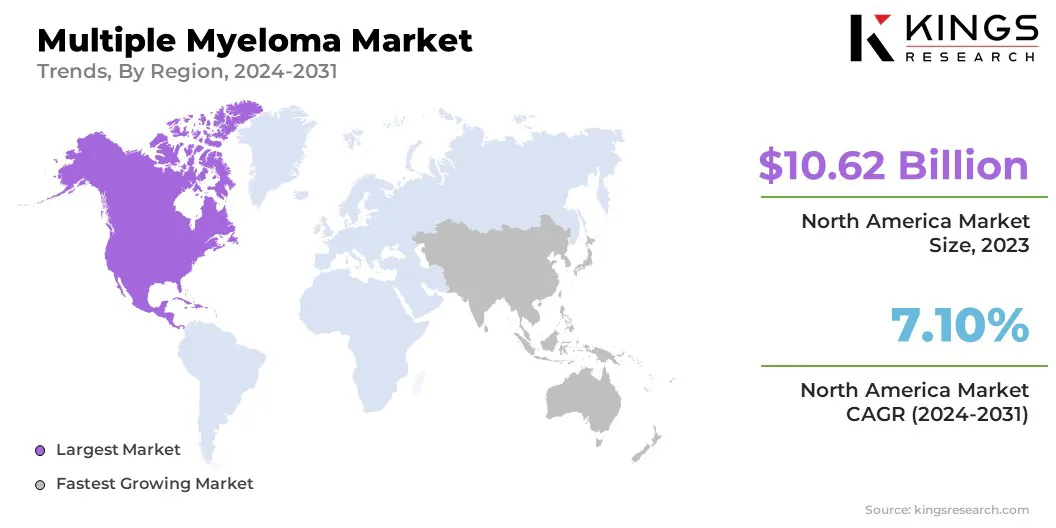
北米は、2023年に多発性骨髄腫市場の45.76%のシェアを占め、106億2,000万米ドルの評価を受けました。この市場の支配は、主に高い疾患の有病率、高度な医療インフラストラクチャ、主要な医薬品プレーヤーの強い存在、モノクローナル抗体やCAR T細胞治療などの新しい治療法の迅速な採用に起因しています。さらに、腫瘍学の研究と広範な臨床試験活動への投資は、市場における地域のリーダーシップに大きく貢献しています。
アジア太平洋地域の市場は、予測期間にわたって12.28%の予測CAGRで、最速の成長を登録することが期待されています。この成長は、多発性骨髄腫に対する認識の高まり、医療費の増加、および中国やインドなどの発展途上国全体での現代の治療へのアクセスの改善に起因しています。
高齢者人口の増加、診断能力の拡大、手頃な価格で効果的な治療に対する需要の増加も、この地域での市場の急速な拡大に貢献しています。さらに、国内の製薬会社は腫瘍学の分野にますます参入し、地域の革新と可用性を高めています。
この地域全体の規制機関は、多発性骨髄腫の進行併用療法をより受け入れており、移植不可能な患者の革新的な治療オプションへのより速い承認のタイムラインとより幅広いアクセスを可能にしています。
多発性骨髄腫市場は、市場のポジションを維持および拡大するために戦略的イニシアチブを採用している主要なプレーヤーによって特徴付けられます。多くの人は、治療効果と遅延耐性を高める多ターゲティング療法と併用レジメンに焦点を当てることにより、腫瘍学のポートフォリオを多様化しています。
企業は、投与の利便性を改善し、製品の寿命を延ばすために、ラベルの拡張や再定式化など、ライフサイクル管理戦略も強調しています。
さらに、学術機関やバイオテクノロジー企業とのコラボレーションは初期段階の革新を促進していますが、実際の証拠生成への投資は市場アクセスと支払人の交渉を支援するのに役立ちます。また、市場の参入者は、治療の監視と患者の順守をサポートするために、デジタルヘルスソリューションを活用しています。
最近の開発(マーケティング承認)
よくある質問